3. ショック
ショックは1世紀以上に渡って使われてきた用語であるが、最初の記載は1743年Le Dran1)の「砲弾の貫通創患者が突然虚脱する過程」とされる。1800年代の後半には、Gross
2)、Warren 3)らにより出血性ショックの進行過程が記述され始め、1899年、Crile 4)
により最初のショック研究書が刊行され、加温輸液による中心静脈圧の上昇が記述された。1900年代初頭、第1次世界大戦においてショックのチーム医療が誕生し、Cannon、Baylissらによって集積された負傷兵のデータからtraumatic shockがまとめられた 5) が、ショックの病態には阻血肢のtoxinが強調された。その後、1930年、Blalock 6) およびParsons、Phemister
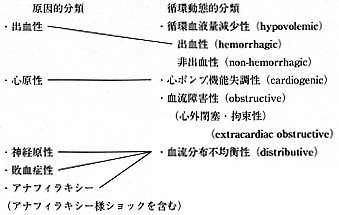
7) らによってショック病態の解明が進み、「血管床と血管内容量の乖離に基づく末梢循環不全」と定義された。現在の原因的分類(表)もBlalock 8) により提唱されたものである。1943年、Cournand 9) は、ショックの血行動態を明らかにし、10項目の診断基準(動脈圧、中心静脈圧、心拍出量、動脈血ガス分析、乳酸値など)はショック治療の迅速な対応と治療成績の向上をもたらした。その後、出血性ショックは、「有効循環量が大量にかつ持続的に喪失する病態であり、結果的に末梢組織が低灌流状態になって毛細血管での交換機能の障害が起こること(Altura 10)
)」、「十分な圧をもって臓器および組織を灌流できないほど心拍出量が低下している状態(Simeone
11) )」と定義された。菌血症によるショックは、1951年、Waisbren
12) によって初めて報告され、血行動態を念頭にした治療が出血性ショックのように劇的に奏功しないことを報告している。1967年、MacLeanら 13) は、hyperdynamic shock of sepsisの病態を初めて報告した。1980年代には、「循環血液量の減少」というキーワードは消失し、「細胞レベルでの基質の供給と需要の不適切なバランスに対して生体が反応できない状態(Cerra 14)
)」、あるいは、「正常な細胞活動を維持するのに組織や臓器の血流が不完全な時に発生する病態で、通常は動脈圧の低下を伴う(Lillehei 15) )という定義に変遷した。90年代以降は、「循環による酸素運搬量が組織の機能と総体的構築を維持するのに必要なATP産生に不十分な状態 16)
」、あるいは「代謝基質(とくに酸素)の不十分な補給あるいは不十分な消費により、乳酸アシドーシスと組織損傷を生ずる病態」が一般的になっている。ショックの分類も、病因的分類から循環動態を重視した分類に変遷した 17)
(表).現在のショック診断基準は、収縮期血圧≦90mmHg、および以下の6項目中3項目以上を満足する場合(心拍数≧100/分、微弱な脈拍、爪床の毛細血管のrefilling遅延≧2秒、意識障害≧10(JCS)あるいは≦10(GCS)、乏尿・無尿(≦0.5ml/kg/hr)、皮膚蒼白と冷汗、または発熱≧39℃)が妥当と考えられる 18) 。ショックにおける生体反応機序は、交感神経活性による血管反応と、液性因子(炎症性メディエーター)の両者の関与が考えられている。したがって、十分な代謝基質(とくに酸素)の供給と微小循環蘇生が進めば、適切な炎症性メディエーター反応により生体は回復に向かうが、代謝基質の供給が不十分でかつ微小循環蘇生に障害がある場合は、組織の酸素負債やBTにより過剰の炎症性メディエーター反応を生じ、これが持続する結果、severe SIRSやMODSへ発展すると考えられる。ショック治療に当たっては、全身と組織あるいは細胞の双方の酸素代謝をモニタリングする必要がある。
表 ショック分類の変遷
文 献
- Le Dran HF:A treatise,or reflections drawn from practice on gunshot wounds(translated).Clarke,London,1743
- Gross SG:A system of surgery:Pathological,Diagnostic,Therapeutic,and Operative.Philadelphia:Lea & Febuger,1872
- Warren JC:Surgical pathology and therapeutics.Philadelphia,WB Saunders,1985
- Crile GW:An experimental research into surgical shock.Philadelphia,JB lippincott,1889
- Cannon WB:Traumatic shock.New York,D.Appleton & Co.,1923
- Blalok.A:Experimental shock,the cause of the low blood pressure proceded by muscle injury.Arch Surg 20:959−96,1930
- Parsons E,Phemister DB:Hemorrhage and shock in traumatized limbs:an experimental study.Surg Gynecol Obstet 51:196−207,1930
- Blalock.A:Shock:Further studies with particular reference to effects of hemorrhage.Arch Surg 29:837,1937
- Cournand A,Riley RL,Bradley SF et al:Studies of the circulation in clinical shock.Surgery 13:964−95,1943
- Altura BM,Lefer AM,Schumer W.ショックの歴史的展望.小山省三翻訳:ショックと外傷.西村書店,1983
- Simeone.FA.Shock.In L.Dabis ed:Christopher’s Textbook of Surgery.Philadelphia:Saunders:58,1964
- Waisbren BA:Bacteremia due to gram‐negative bacilli other than salmonella.Archi Intern Med 88:467−88,1951
- MarLean LD,Mulligan WG,McLean APH et al:Patterns of septic shock in man:a detailed study of 56 patients.Ann Surg 166:543−57,1967
- Cerra,FB.Shock.In Burke JF ed:Surgical Physiology.Philadelphia:Saunders:497,1983
- 玉熊正悦.ショック研究の歩みと展望.玉熊正悦編:ショック1995−1996.中山書店:9,1995
- Fiddian‐Green RG,Haglund ULF,Gutierrez G.et al.Goals for the resuscitation of shock.Crit Care Med 21:S25−S31,1993
- Cunnion RE,Parrillo JE.Cardiovascular diseases.In Parillo JE,Masur H(eds.),The critically ill immunosuppressed patient.Pockville:Aspen publishers:3−38,1987
- 相川直樹:ショック(1),診断と緊急処置.相川直樹,堀 進悟(編):救急レジデントマニュアル(第2版).医学書院:44−8,1998
参考文献抄録
1)脱血性ショックにおけるBacterial Translocationの意義−in situ hybridization法によるgut hypothesisの検討−
感染の有無とは別にSIRS等の強い全身性反応発生にサイトカインが重要な役割を果たすといわれている。今回脱血性ショックにおけるBacterial Translocation(BT)の発生とtumor necrosis factor(TNF)の遺伝子発現をin situ hybridization法を用いて検討した。BTの発生を認めたラットの回腸パネート細胞と腸間膜リンパ節にTNFmRNAの発現を認めた。更にBTの発生がTNFmRNAの発現と同じ部位で確認されたことより、BT発生とサイトカイン生産は密接に関連していることが示唆された。BTの発生は宿主が侵襲に反応してサイトカインを産生する準備状態となると考えられ、脱血性ショック下の腸管壁や腸間膜リンパ節で産生されるサイトカインの一つであるTNFは、生体における免疫反応の第一段階である可能性が示唆された。一般には感染モデルと考えられていない出血性ショックにおいてもBTという感染性現象により宿主が影響を受けると思われる。
藤野光廣,谷 徹,小玉正智:外科と代謝・栄養,32(1):1−8,1999
2)Animal models of sepsis and shock:a review and lessons leared.
Over the past decade,the biotechnology/pharmaceutical industry has been diligently working on the development of immuno‐modulatory agents for the treatment of shock and sepsis,and the literature is rife with descriptions of novel and innovative molecules that promise to become the panacea for these conditions.Unfortunately,despite promising preclinical evidence,dozens of these new agents have failed to demonstrate clinical efficacy in controlled,randomized clinical trials,abandoning the bedside physician to the traditional armamentarium of drugs and therapeutics for the treatment of patients with these complex,progressive, and life‐threatening conditions.The reasons for this quandary are controversial,complex,and multifactorial.This review focuses on the concept that the preclinical trials of many of these agents were conducted using models of sepsis and shock that do not adequately reflect the clinical realities of these conditions.As a result,it is not surprising that clinical trials of agents based on clinically flawed models failed to demonstrate clinical efficacy.The lack of clinical insight during preclinical development of these agents has contributed to the current impasse of the development of safe,efficacious,and potentially lifesaving agents for the treatment of shock and sepsis.Thus,the goal of this review article is to review the advantages and disadvantages of commonly used sepsis and shock models in light of lessons learned from these clinical trials [References:52]
Deitch EA:Shock 9:1−11,1998
3)Mild or moderate hypothermia but not increased oxygen breathing prolongs survival during lethal uncontrolled hemorrhagic shock in rats with monitoring of visceral dysoxia.
OBJECTIVE:To test the hypotheses that during lethal uncontrolled hemorrhagic shock(UHS)in rats compared with normothermia and room air breathing:a)mild hypothermia would prolong survival time as well as moderate hypothermia;b)oxygen breathing would prolong survival further;and c)hypothermia and oxygen would mitigate visceral ischemia(dysoxia)during UHS.DESIGN:Prospective,randomized,controlled laboratory animal study.SETTING:Animal research facility.SUBJECTS:Male Sprague‐Dawley rats.INTERVENTION:Fifty‐four rats were lightly anesthetized with halothane during spontaneous breathing.UHS was induced by blood withdrawal of 3mL/100g over 15 mins,followed by 75% tail amputation with topical application of heparin.Five minutes after tail cut,rats were randomly divided into nine groups (6 rats each) with three rectal temperature levels (38 degrees C [100.4 degrees F;normothermia]) vs.34 Degrees C [93.2 degrees F;mild hypothermia] vs. 30 degrees C [86 degrees F;moderate] Hypothermia] by surface cooling;each with 3 FIO2 levels (0.25 vs.0.5 vs.1.0).Rats were observed without fluid resuscitation until death (apnea and pulselessness).Visceral ischemia was monitored by observing liver and gut surface PCO2.MEASUREMENTS AND MAIN RESULTS:Mean survival time,which was 51 mins in the control group with normothermia and FIO2 of 0.25,was more than doubled with hypothermia,to 119 mins in the combined mild hypothermia groups (p<.05) and to 132 mins in the combined moderate hypothermia groups (p<.05;NS for moderate vs.mild hypothermia).FIO2 had no statistically significant effect on survival time.Increases in visceral surface PCO2 correlated with hypothermia,(r2=.22 for intestine and .40 for liver).Transiently,increased FIO2,not hypothermia,mitigated visceral ischemia.CONCLUSIONS:Both mild and moderate hypothermia prolonged survival time during untreated,lethal UHS in rats.Increased FIO2 had no effect on survival.The effects of hypothermia and increased FIO2 during UHS on viscera,the ability to be resuscitated,and outcome should be explored further.
Takasu A.Carrillo P.Stezoski SW.Safar P.Tisherman SA:Critical Care Medicine.27(8):1557−64,1999 Aug.
関 連 用 語
| 英文表記 | 略語 | 和文表記 | 定 義 ・ 備 考 |
|---|---|---|---|
| infection | 感染 | 微生物の存在、あるいは正常では無菌状態の宿主組織内への微生物の侵入に対する炎症反応。 | |
| bacteremia | 菌血症 | 血中での細菌の存在。血液培養陽性によって確認される。 | |
| systemic inflammatory response syndrome |
SIRS | 全身性炎症 反応症候群 |
侵襲に対する全身性炎症反応で以下の二項目以上が該当するときSIRSと診断する。 (1)体温>38℃または<36℃ (2)心拍数>90/分 (3)呼吸数>20/分またはPaCO2<32Torr (4)末梢血白血球数>12,000mm 3 または<4,000/mm 3 あるいは未熟顆粒球(band)>10% |
| sepsis | セプシス | 感染に対する全身性炎症反応で、SIRSと同一の診断基準を満足するもの、すなわち、sepsisは感染によるSIRS。 | |
| severe sepsis | 重症セプシス | 臓器機能障害・循環不全(乳酸アシドーシス、乏尿、急性意識障害など)あるいは血圧低下(収縮期血圧<90mmHgまたは平時の収縮期血圧より40mmHg以下の血圧低下)を合併するセプシス。 | |
| septic shock | セプティック ショック |
重症セプシスの一分症(subset)。適切な補液でも持続する血圧低下(収縮期血圧<90mmHgまたは平時の収縮期血圧より40mmHg以上の血圧低下)で、セプシスに合併するもの。血管作動薬使用により血圧が維持されている場合でも、臓器機能障害・循環不全(乳酸アシドーシス、乏尿、急性意識障害など)があれば、セプティックショックとする。 | |
| multiple organ dysfunction syndrome |
MODS | 多臓器機能 障害症候群 |
サポート無しでは恒常性が維持できない急性期患者における臓器機能障害の存在。 |
| obstructive shock (extracardiac obstructive shock) |
血流障害性 ショック (心外閉塞・拘束性ショック) |
外部からの圧迫(心タンポナーデにおける心嚢液の貯蓄など)による心筋収縮力の低下あるいは大静脈・肺血管抵抗の増強(緊張性気胸における胸腔内圧の上昇、肺塞栓症)による心拍出量の低下を原因とするショック。 | |
| distributive shock | 血流分布不均衡性ショック | ある血管床のシャント血流の増加により、他の血管床の灌流を十分に維持するのに適切な心拍出量を維持できなくなっている状態。 細菌感染、細菌菌体毒素、過剰な炎症性反応、アナフィラキシー、中枢神経の機能不全、急性中毒などに起因する。 |
|
| oligemic shock | 循環血液量減少性ショック | 拡張末期心室内容量の低下に基づくショック。 | |
| cardiogenic shock | 心原性ショック | 心筋収縮力の低下に基づくショック。 | |
| tissue hypoxia | 組織酸素 代謝失調 |
微小循環の自動能の破綻により酸素摂取の代償機転が作用しない結果、組織の酸素要求量を満たす酸素運搬が行われなくなり、組織の酸素負債が発生している状態。 |